南医大公共卫生学院钱旭课题组/浙江大学转化医学研究院吕志民课题组
KDM3A感受低氧微环境,通过调节PGC-1a甲基化水平调控肿瘤细胞线粒体生物合成
动物细胞感知和适应氧气的变化是生命活动的重要基础。2019年诺贝尔生理学或医学奖授予了William G. Kaelin Jr.、Peter J. Ratcliffe和Gregg L. Semenza,以表彰他们在揭示细胞感知和适应氧气供应机制方面做出的杰出贡献。线粒体是细胞内最主要的耗氧细胞器,也是细胞代谢的核心场所,为细胞提供充足的能量和物质。实体肿瘤由于快速生长,其核心区域常处于低氧状态。在低氧情况下,线粒体易受损伤,导致肿瘤细胞发生凋亡。因此,肿瘤细胞如何感知低氧微环境、主动平衡低氧与线粒体耗氧之间的矛盾是促进肿瘤生存的关键之一,也是亟待解决的重要科学问题。
本研究首次发现,控制线粒体生物合成的关键基因过氧化物酶体增殖物激活受体γ辅激活物-1a(PGC-1a)在低氧下,其224位赖氨酸(K)残基发生单甲基化。该甲基化阻止PGC-1a与其下游转录因子NRF1/2结合,并抑制了NRF1/2转录活性,导致线粒体DNA拷贝数和氧化呼吸能力降低。为了进一步明确低氧导致PGC-1a发生甲基化修饰的原因,研究人员通过筛选发现组蛋白去甲基化酶KDM3A参与其中,它能够去除PGC-1aK224甲基化修饰,并且这一生物化学反应需要氧气参与。在低氧情况下,KDM3A由于缺少氧气而活性降低,导致PGC-1aK224甲基化水平升高,线粒体生物合成和氧气消耗水平降低,肿瘤细胞生存能力增强。更重要的发现,PGC-1aK224甲基化水平与胶质瘤患者肿瘤组织微环境中低氧指标HIF-1a呈正相关:HIF-1α表达越高,PGC-1aK224甲基化水平越高,提示该研究所发现的分子机制具有重要的病理参考价值。
以上研究结果对于深入理解胶质瘤低氧微环境的内在机制具有重要意义,也为临床肿瘤治疗提供新的分子靶标和思路。
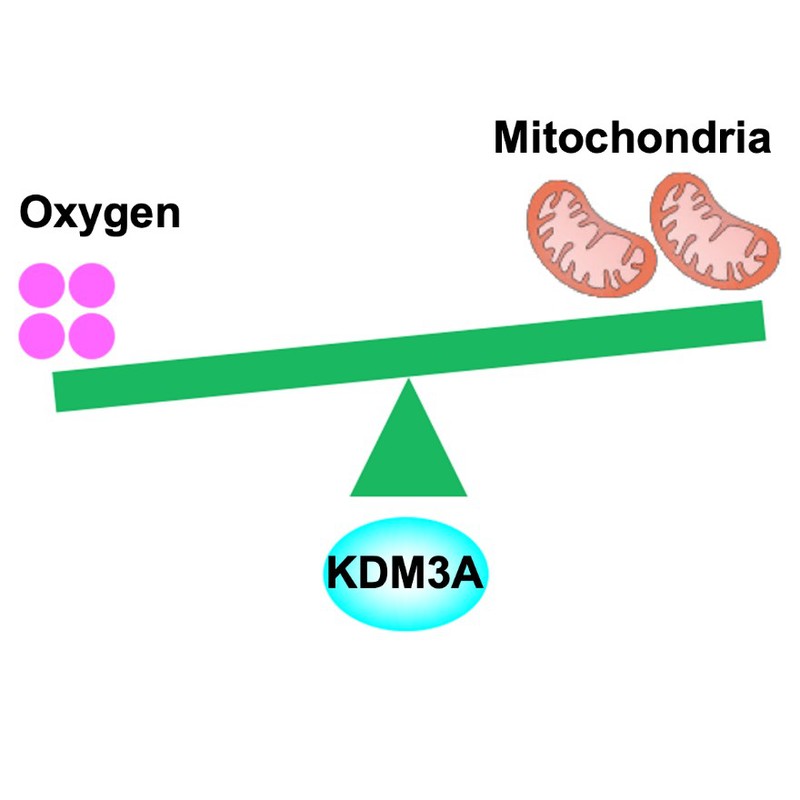
图1. KDM3A感受氧气浓度,调节线粒体生物合成模式图
时间:2019年10月
刊物:Molecular Cell
标题:KDM3A senses oxygen availability to regulate PGC-1a-mediated mitochondrial biogenesis
原文链接:![]() 2019 KDM3A mitochondrial biogenesis--Mol Cell.pdf
2019 KDM3A mitochondrial biogenesis--Mol Cell.pdf
